Winzige Lipid-Nanopartikel fungieren als Transportmittel – dabei werden sie einfach ins Blut injiziert, lösen sich in den Gefäßen auf und geben mikroRNA frei.
Forscher der Medizinischen Hochschule Hannover (MHH) konnten im Mausmodell geschädigte Blutgefäße mittels Nanopartikel-Therapie reparieren. Dies gelingt, in dem mikroRNA mittels Nanopartikel ins Blut transportiert werden und dort die Heilung von Gefäßinnenwänden fördern.
Nanopartikel-Therapie für die Blutgefäße
Blutgefäße sind innen mit einer schützenden Zellschicht, dem Endothel, ausgekleidet. Im Laufe des Lebens nutzt sich diese Schicht ab, die Gefäßewände verdicken und verkalken. Diese Veränderungen sind häufig Ursache für Erkrankungen wie Herzinfarkt oder Schlaganfall.
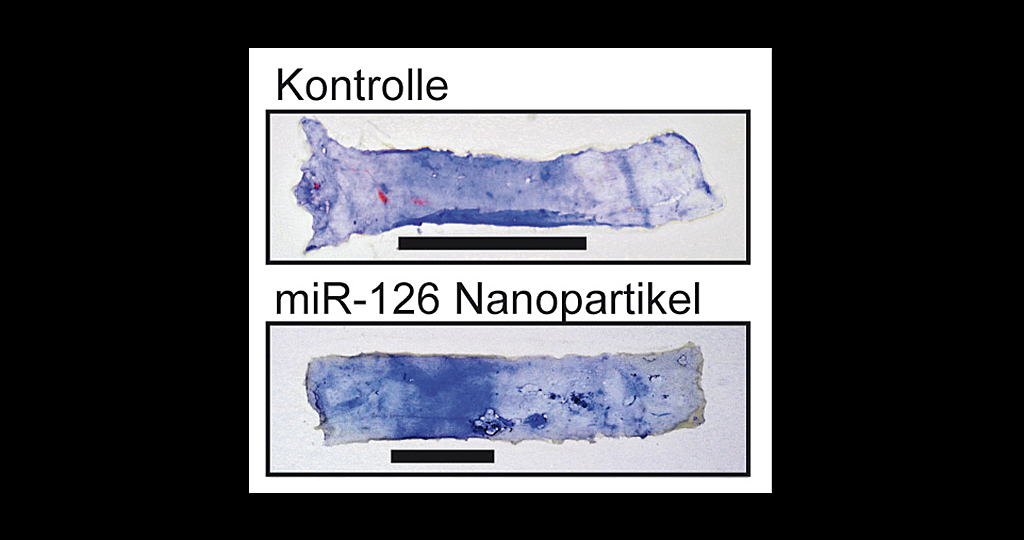
Forscher der Medizinischen Hochschule Hannover (MHH) haben eine neue Therapie zur Heilung derart geschädigter Gefäße entwickelt: Das Team um Professor Dr. Dr. Thomas Thum, Dr. Jan Fiedler und Dr. Dorothee Hartmann vom MHH-Institut für Molekulare und Translationale Therapiestrategien brachten bestimmte Ribonukleinsäureketten (MicroRNA-126) über winzige abbaubare Partikel in geschädigte Gefäße ein: Die Zellen geschädigter Gefäßinnenwände erneuerten sich daraufhin deutlich schneller, das Gefäß konnte wieder repariert werden.
Die Möglichkeit der Nanopartikel-Therapie bewiesen die Wissenschaftler anhand von Versuchen im Mausmodell sowie an menschlichen Gewebeproben. „Verletzungen der Gefäßinnenwand entstehen unter anderem auch beim Einsetzen von sogenannten Stents, die eigentlich verengte Gefäße weiten sollen“, erklärt Professor Dr. Dr. Thomas Thum. „Unsere neue Therapie könnte helfen, dass sich um die Stents herum die Schutzschicht schneller ausbildet und so Nebenwirkungen wie Thrombenbildung verhindern.“
Lipid-Nanopartikel als Transportmittel
Der Clou der entwickelten Therapie sind die winzigen Lipid-Nanopartikel, die die Wissenschaftler als Transportmittel nutzen. Sie können einfach ins Blut injiziert werden, lösen sich dann in den Gefäßen auf und geben die mikroRNA frei. „Dort regulieren die mikroRNA wichtige Signalwege, die für die Instandhaltung der Gefäßinnenwand wichtig ist „, sagt Dr. Fiedler, der sich die Erstautorenschaft mit Dr. Dorothee Hartmann teilt. „Durch das Einbringen der mikroRNA heilt die innere Schutzschicht schneller wieder.“
MicroRNAs sind kurze Ribonukleinsäureketten. Sie wirken zumeist auf ein ganzes Netzwerk von Genen und steuern darüber die Entwicklung und Funktion von Zellen. Das Institut für Molekulare und Translationale Therapiestrategien ist an der MHH in das Integrierte Forschungs- und Behandlungszentrum Transplantation (IFB-Tx) und in den Exzellenzcluster REBIRTH eingebunden.
Die Originalpublikation steht im Internet unter folgendem Link: http://circ.ahajournals.org/content/early/2016/10/24/CIRCULATIONAHA.116.022478.