Innsbrucker Physiker bestätigen Modell für Doppelstrangbrüche der DNA
Doppelstrangbrüche der DNA bewirken schwere Schäden in der Erbinformation: Sie können dazu führen, dass Tumorgewebe entsteht. Forscher der Universität Innsbruck bestätigten nun in Experimenten erstmals ein Modell, das erklärt, wie es zu solchen Veränderungen kommt. Die Physiker berichten darüber in der aktuellen Ausgabe der Fachzeitschrift Angewandte Chemie International Edition.
Eine erhöhte Strahlenbelastung kann bei einem Menschen einen Krebstumor wahrscheinlicher machen – andererseits wird gezielte Bestrahlung in der Medizin auch zur Behandlung von Tumoren verwendet. Dabei werden Körperzellen nicht direkt durch die energetische Strahlung geschädigt, sondern durch dabei freigesetzte Radikale, also Atome oder Moleküle mit mindestens einem ungepaarten Elektron. Ein solches Radikal ist zum Beispiel das Hydroxyl (OH•), das aus je einem Atom Wasserstoff (H) und Sauerstoff (O) besteht. Wie für Radikale typisch, ist das Hydroxyl besonders reaktionsfreudig und kann chemische Veränderungen im Zellmaterial auslösen. Doppelstrangbrüche der DNA zählen dabei zu den problematischsten Schäden, da sie Geninformationen bei mangelnder Reparatur nachhaltig ändern.
Wasser in der Zelle entscheidend
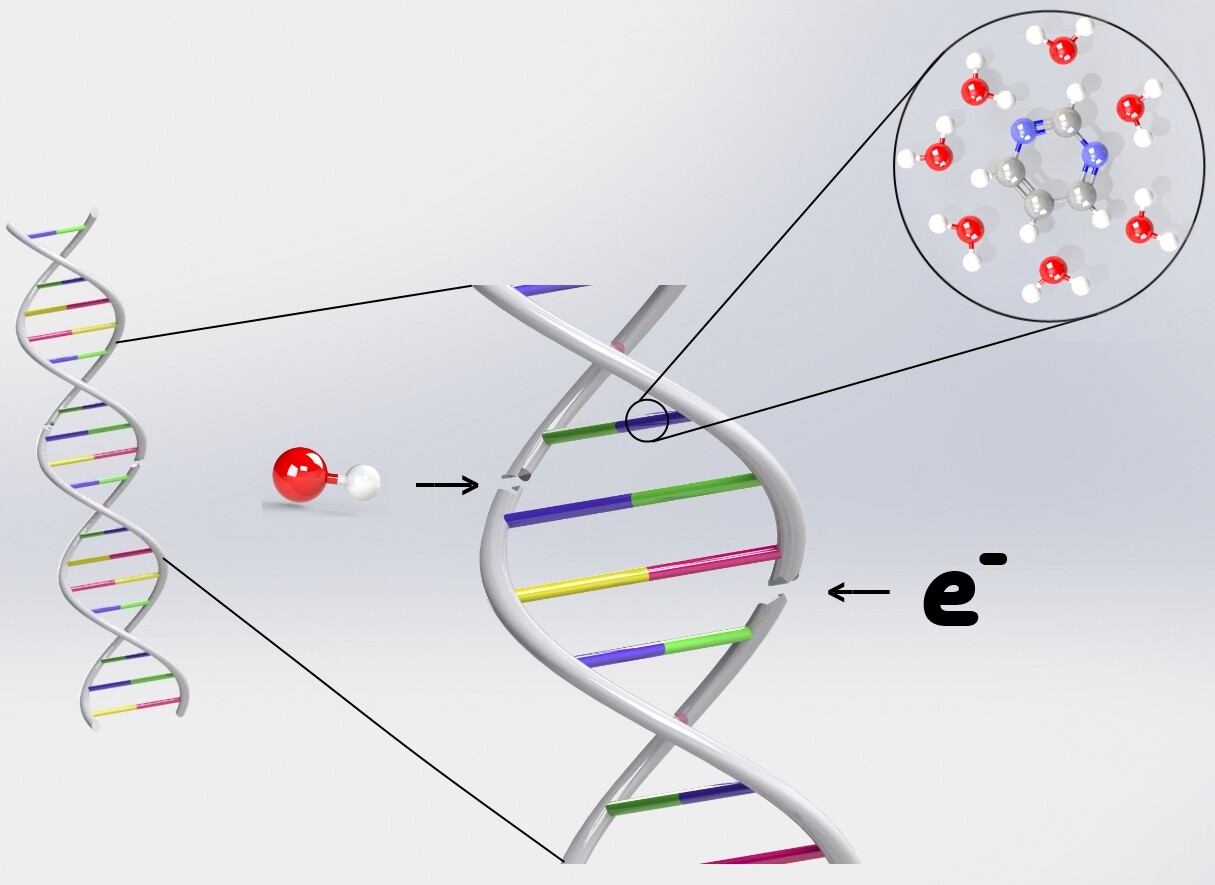
Erst im Jahr 2000 wurde gezeigt, dass auch niederenergetische Elektronen, die in großer Menge auch durch energetische Strahlung in Zellen freigesetzt werden, über Anlagerung an den Molekülen der DNA eine oder beide ihrer Stränge brechen können. Seitdem suchen Forscher nach den möglichen molekularen Vorgängen, die das verursachen. Bei Einzelstrangbrüchen ist der Ablauf mittlerweile mehr oder weniger geklärt. So ist es möglich, dass ein Elektron sich im Bereich des DNA-Rückgrats anlagert und dabei die chemische Bindung eines einzelnen Strangs so sehr schwächt, bis er bricht. Wie aber Elektronenanlagerung auch einen Doppelstrang brechen könnte, ist bislang ungeklärt. Es wird vermutet, dass dabei das Wasser entscheidend ist, das sich in der Zelle befindet: Ein Elektron lagert sich an den Wasser-DNA-Komplex an und regt den Komplex elektronisch an, bevor es wieder freigesetzt wird. Der neutrale Komplex ist durch die Anregung instabil und zerfällt. Dabei wird ein OH-Radikal ausgesendet. Das nun freigewordene Elektron und das OH-Radikal können damit einen Doppelstrangbruch verursachen.
Die Arbeitsgruppe um Stephan Denifl am Institut für Ionenphysik und Angewandte Physik erzeugte nun im Labor sehr kleine Anhäufungen (sogenannte Cluster) von bis zu 25 Stück einer für die DNA typischen Sorte Biomoleküle und untersuchte, wie sich Elektronen daran anlagern. Damit lassen sich einzelne Reaktionsschritte gezielter aufzeigen, als es bei Experimenten mit Riesenmolekülen wie der DNA möglich wäre. Über ihre Beobachtungen berichten die Forscher in der aktuellen Ausgabe der Fachzeitschrift Angewandte Chemie International Edition. „Dabei wählten wir das Pyrimidin-Molekül, da es einen Grundbestandteil der DNA darstellt. Wir konnten aus wenigen einzelnen Molekülen kleine Cluster erzeugen und haben diese mit niederenergetischen Elektronen beschossen“, erklärt Michael Neustetter, der Erstautor dieser Studie. Dabei zeigte sich bei reinen Pyrimidin-Clustern, dass die im Cluster gebildeten Ionen trotz des zusätzlichen Elektrons stabil sind und deshalb auch mittels Massenspektrometrie messbar sind, da sich die zugeführte Energie im Pyrimidin-Cluster verteilt. Dies wurde selbst dann beobachtet, wenn das eingefangene Elektron genügend Energie hatte, um den Komplex auch elektronisch anzuregen. Letzteres Ergebnis ändert sich aber drastisch, wenn Pyrimidin im Cluster von Wassermolekülen umgeben ist: Es werden nun keine negativen Ionen mehr beobachtet, was bedeutet, dass das Elektron sich nur kurzeitig anlagert und den angeregten Komplex wieder verlässt. „Diese Resultate entsprechen genau den ersten bisher experimentell fehlenden Reaktionsschritten im vermuteten Modell von elektronen-induzierten DNA-Doppelstrangbrüchen“, erklärt Stephan Denifl. Die theoretisch vermutete Reaktion auf dem Weg zur DNA-Schädigung konnte damit nun auch experimentell gezeigt werden.