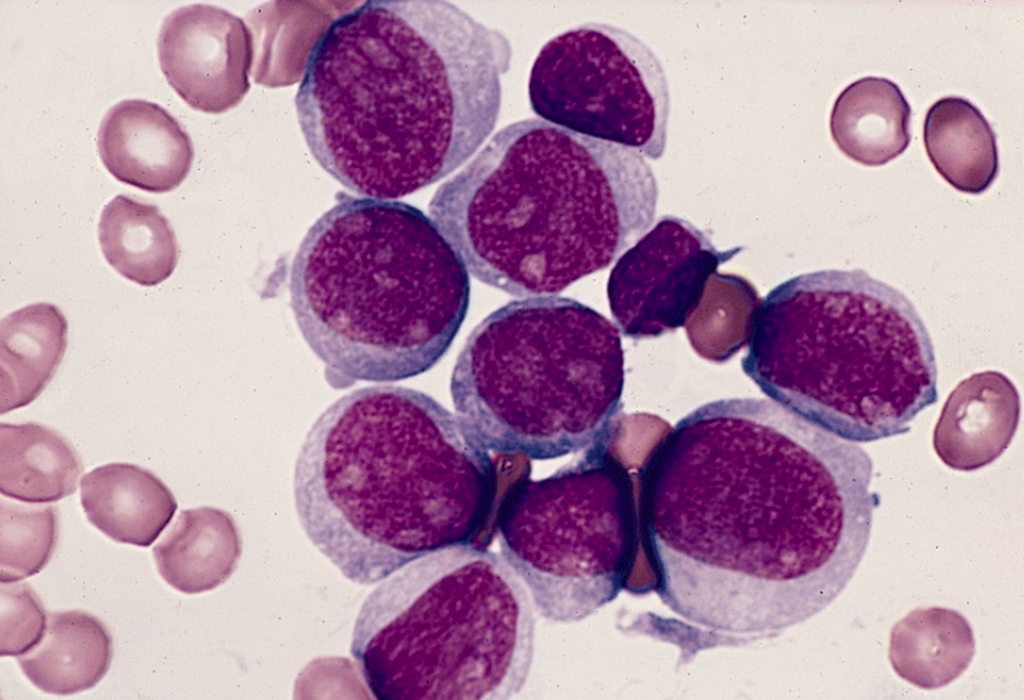
Die akute myeloische Leukämie zeigt sich bei etwa 10 bis 20% der Patienten primär als Therapie-refraktär. Nach wie vor ist die Behandlung eine große Herausforderung.
Die akute myeloische Leukämie (AML) macht etwa 80% der akuten Leukämien bei Erwachsenen aus. Dabei erhöht sich die Inzidenz der Erkrankung auf 17/100.000/Einwohner/Jahr. Wobei das mittlere Erkrankungsalter bei 63 Jahren liegt. Trotz der großen onkologischen und hämatologischen Fortschritte ist allerdings die Akute myeloische Leukämie-Therapie in den letzten Jahrzehnten unverändert geblieben. Nach wie vor stirbt schließlich die Mehrzahl der Patienten. Die Allogene Stammzelltansplantation bleibt die beste Heilungschance für Patienten mit mittelschwerer oder hochriskanter Erkrankung. Weil ist die Therapie sehr belastet und lange dauert, sollten sich die Patienten umfassend über die Akute myeloische Leukämie informieren. Auch deren Angehörige sollten genau Bescheid wissen.
Pathogenese
Neben Therapie-assoziierten Formen (t-AML) nach Alkylantien-, Topoisomerase-II-Gabe etc. werden sekundäre Akute myeloische Leukämie-(s-AML)-Formen – entstehend aus einem vorangegangenen myelodysplastischen Syndrom oder einer myeloproliferativen Erkrankung – von einer de vovo AML unterschieden.
Funktionelle Untersuchungen im Mäusemodell sprechen für einen malignen Klon der Akuten myeloischen Leukämie, bestehend aus einem großen Anteil leukämischer Myeloblasten und einem kleinen Anteil leukämischer Stammzellen (LCS) mit dem Potenzial der Selbsterneuerung.
Die LCS sind in der Lage, dauerhaft alle Zellen des leukämischen Klons zu bilden. Durch Persistenz der LCS kann eine minimale Resterkrankung bleiben, wodurch das Rezidiv der Akuten myeloischen Leukämie entsteht. Epidemiologische und genotypische Untersuchungen weisen darauf hin, dass auch bei AML – wie bei anderen Neoplasien – zwei oder mehr Mutationen krankheitsauslösend sind. Die Expression von PML-RARα alleine löst im Tierexperiment nur bei einem geringen Prozentsatz eine Akute myeloische Leukämie (M3) aus.
Ist zusätzlich eine Tandemduplikation von FLT3 vorhanden (welche bei AML häufig vorkommt), kommt es im Tiermodell regelmäßig zur Entwicklung einer Akuten myeloischen Leukämie.
Diagnostik
Die traditionelle FAB (French-American-British)-Klassifikation der AML basiert auf dem zytologischen Bild der Blasten (M0–M7) sowie ihren zytochemischen Eigenschaften. Die modernere WHO-Klassifikation der Akuten myeloischen Leukämie unterscheidet sich durch den für die Diagnose einer AML benötigten Blastenanteil. Entsprechend den WHO-Kriterien besteht eine Akute myeloische Leukämie bereits ab 20% Blasten, während die FAB-Kriterien 30% verlangen. Als hauptsächliche Begründung dafür wurde angegeben, dass der klinische Verlauf von Patienten mit einem Blastenanteil von 20–30% dem einer AML entspricht und de facto fast alle diese Patienten mit therapeutischen AML-Protokollen behandelt wurden. Weiters fließen in die WHO-Klassifikation zytogenetische Aspekte, z.B. t(8;21), t(15;17), inv(16) wie auch mutagene Ereignisse und die Knochenmarksdysplasie ein.
Der Stellenwert der Immunphänotypisierung für die Diagnostik einer Akuten myeloischen Leukämie liegt vor allem in der Erkennung undifferenzierter myeloischer Leukämien, die morphologisch und zytochemisch nicht eindeutig von lymphatischen Leukämien abgegrenzt werden können. Mittels Molekulargenetik kann ein suffizientes molekulares Monitoring durchgeführt werden. Bei M3 hat z.B. die Persistenz des Fusionstranskripts PML-RARα eine entscheidende prognostische Bedeutung und positive PCR-Befunde ziehen therapeutische Konsequenzen nach sich.
Akute myeloische Leukämie kann man heute mit verschiedenen Therapie-Strategien behandeln.
Im Grunde genommen besteht die Standardtherapie typischerweise in einer Induktionstherapie (Anthrazyklin, Cytosinarabinosid), um eine komplette Remission zu erreichen. Damit kann man Remissionsraten von 70–80% bei Patienten unter 60 Jahren und 60–70% bei jenen über 60 Jahren erreichen.
Jedenfalls kann man bei Patienten unter 60 Jahren kann durch hochdosiertes Ara-C (2 x 3mg/m2) an drei Tagen (2 bis 4 Zyklen) eine höhere Überlebensrate erreichen. Zudem kann eine allogene Transplantation bei passendem Spender (Geschwister oder Fremdspender) den jüngeren Patienten helfen.
In den letzten Jahren hat sich an der Standardtherapie der AML nichts wesentlich geändert. Der Einsatz von neuen Therapiestrategien mit zielgerichteten Substanzen eröffnet sicher neue therapeutische Optionen. Dies muss allerdings durch entsprechende Studienergebnisse nachgewiesen werden.
Die Akute Myeloische Leukämie bedarf einer intensivierten, mehrphasigen Chemo-Therapie:
- Induktionsphase mit hochdosierten Chemotherapeutika über mehrere Wochen
- Konsolidierungsphase mit anschließender Zytostatika-Therapie mit mittelhoch dosierten Wirkstoffen über mehrere Monate.
- Erhaltungstherapie über bis zu zwei Jahre in niedriger Dosierung.
Schließlich stellt die allogene Stammzelltransplantation einen kurativen Ansatz dar.
Neue Medikamente
Unter dem Strich gibt es auch eine Reihe neuer Medikamente, die man derzeit im Rahmen von Studien erforscht. Vor allem wenn die Akute Myeloische Leukämie nicht auf die Therapie anspricht (Therapieversagen), sollte der Arzt dies erwägen.
Hierzu ist der bereits zugelassene Multikinaseinhibitor Midostaurin eine neue Option. Dabei kann der neue Wirkstoff für AML-Patienten im Zusammenhang mit einer FTL3- Mutation von Nutzen sein. Die unerwünschten Wirkungen des Arzneimittels sind angesichts der schweren Erkrankung akzeptabel sowie auch beherrschbar.
Ein weitere Option ist schließlich das Decitabin. Der Wirkstoff hat in Kombination mit der Chemotherapie oder der molekularen Therapie bei refraktärer oder rezidivierter Patienten mit AML wirksame Eigenschaften gezeigt.
Literatur:
Jennifer N. Saultz, Ramiro Garzon. Acute Myeloid Leukemia: A Concise Review. J Clin Med. 2016 Mar; 5(3): 33. Published online 2016 Mar 5. doi: 10.3390/jcm5030033
Ma et al. Use of decitabine for patients with refractory or relapsed acute myeloid leukemia. A systematic review and meta-analysis. Hematology. 2019 Dec;24(1):507-515. doi: 10.1080/16078454.2019.1632407.
Katrin Ottersbach. Endothelial-to-haematopoietic transition: an update on the process of making blood. Biochem Soc Trans. 2019 Apr 30; 47(2): 591–601. Published online 2019 Mar 22. doi: 10.1042/BST20180320